電池の基本構成と充放電の原理:知っておきたい 電池の仕組み(2)(4/6 ページ)
新しい電池の反応
新しい電池の反応の特徴として、インターカレーション型とロッキングチェア型電池について説明します。図6はリチウムイオン電池の動作原理の模式図です。まず、電極の材料に注目した特徴がインターカレーション型です。
リチウムイオン電池の材料はプラス極とマイナス極共に層構造の結晶をしており、その間にリチウムが挟みこまれた構造をしています。これをインターカレーション型と呼びます。また、電解液に注目した特徴がロッキングチェア型です。リチウムイオン電池では、充電の際はリチウムイオンがプラス極からマイナス極へ、放電の際はマイナス極からプラス極へ移動していく、行ったり来たりする反応であり、トータルのリチウムイオンの量は変わりません。これをロッキングチェア型と呼びます。
まず、インターカレーション型の特徴を述べます。従来の電池のタイプは電極の材料が放電と充電を繰り返すうちに、金属(または化合物)が溶解と析出を繰り返すことになります。このときに、溶解した金属が必ずしも同じ部分に析出するとは限らないので、電極の形状が変化して凸凹になってしまいます。
この状態が続けば、針状に成長して反対の電極まで接触するとショートしてしまうことも生じます。ショートを防ぐためには、プラス極とマイナス極の間は余裕を持った間隔が必要でした。
一方、インターカレーション型はスポンジの穴の中に金属が埋めこめられた状態とイメージすると分かりやすいです。放電と充電を繰り返すと、穴の中の金属が溶けたり、戻ったりするだけの状態です。電極があまり変形しないので、ショートが生じにくい特徴があり、コンパクトに設計することも可能です。インターカレーション型は挿入を意味するインサーション型と呼ばれることもあります。
次に、ロッキングチェア型の特徴を示します。まず、従来の電池として、鉛電池を例にとると、放電時には、プラス極、マイナス極共に鉛イオンが溶け出します。放電が続けば、電解液(希硫酸)中の鉛イオンの濃度が徐々に濃くなっていきます。
充電時には、逆に鉛イオンの濃度が薄くなっていきます。電極材料がいったん電解液に蓄えられるといえるので、リザーブ型と呼ばれます。このように、リザーブ型の電池は電解液の濃度変化があるので、ある程度の電解液の量が必要となります。
一方、ロッキングチェア型の代表であるリチウムイオン電池では、放電時に、リチウムイオン電池がマイナス極からプラス極に移動しますが、電解液中のリチウムイオン濃度は変化しません。つまり、電解液のリチウムイオンは単に移動するだけで、蓄える必要が無いので、電解液を極力少なくすることができます。この点もコンパクトな電池を作ることができる特徴となります。なお、ロッキングチェア型はシーソー型やシャトルコック型と呼ばれることもあります。
Copyright © ITmedia, Inc. All Rights Reserved.
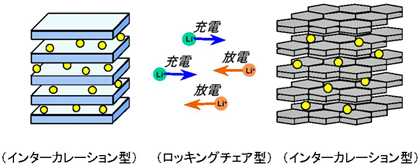 図6 リチウムイオン電池の反応模式図
図6 リチウムイオン電池の反応模式図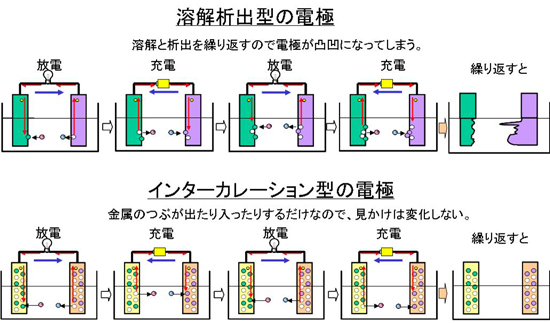 図7 インターカレーション型電極(電極に注目)
図7 インターカレーション型電極(電極に注目)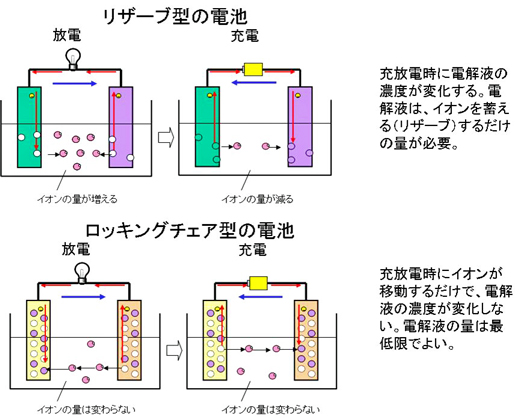 図8 ロッキングチェア型反応(電解液に注目)
図8 ロッキングチェア型反応(電解液に注目)